A Agência Nacional de Vigilância Sanitária (Anvisa) está reunida neste momento para decidir os pedidos de autorização para uso emergencial de vacinas contra a Covid-19. A diretoria colegiada do órgão começou a discutir as solicitações às 10h.
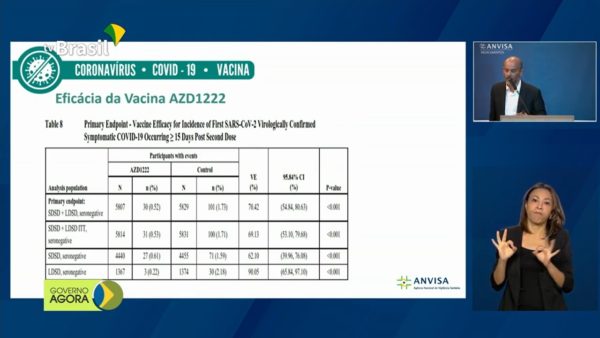
Na reunião, a equipe técnica da Anvisa recomendou aprovação do uso emergencial das vacinas CoronaVac e Oxford, produzidas no Brasil em parceria com as farmacêuticas Sinovac (China) e Astrazeneca (Inglaterra).
Caso os cinco diretores da Anvisa aprovem a recomendação técnica, a vacinação no Brasil deverá começar em cinco dias.
O Instituto Butantan, em parceria com a farmacêutica chinesa Sinovac, e a Fundação Oswaldo Cruz (Fiocruz), parceira do consórcio Astrazeneca/Oxford, entraram com requerimentos de autorização em caráter emergencial para suas vacinas.
A primeira etapa de verificação analisou se a documentação e as informações essenciais estavam nos materiais apresentados pelos centros de pesquisa. Após essa triagem, os técnicos da Anvisa passaram a examinar os relatórios enviados e os dados constantes nos requerimentos submetidos.
No total, três áreas da agência fizeram exame da documentação apresentada: a de registro de medicamentos, a de boas práticas de fabricação e a de farmacovigilância de medicamentos. Cada setor elaborou um parecer, que servirá como subsídio para a análise e decisão da diretoria colegiada.
Fonte: Agência Brasil/Anvisa
Foto: Divulgação







Comente